为什么会得骨髓增生异常综合征(MDS)?还可以治愈吗?
什么是骨髓增生异常综合征(MDS)?发病机制是什么?如何诊断分型?预后怎么样呢?怎么治疗更好呢……高博医学(血液病)北京研究中心·北京博仁医院李智慧医生为患者和家属朋友进行了全面细致科普,希望为大家带来指导和帮助~
骨髓增生异常综合征(MDS)是起源于造血干细胞的一组异质性髓系克隆性疾病,特点是髓系细胞发育异常,主要表现为无效造血、难治性血细胞减少,既有骨髓衰竭特征又有向急性髓系白血病(AML)转化的高风险。
1976 年后随着对疾病认识的发展,将 MDS 分为 RAEB、CMML 等类型,直到 2016 年世界卫生组织(WHO)将 MDS 的分类确立为 MDS-SLD、MDS-MLD、MDS-EB1、MDS-EB2、5q-syndrome、MDS-U 等几种类型。
MDS 是一种老年性疾病,好发于 70 岁以上人群。MDS 年发病率为 2.1-12.6/10 万人,70 岁以上人群的发病率是普通人群的 25 倍,平均诊断年龄为 70-75 岁,而中国的发病年龄为 49-62 岁。MDS 的发病还具有地域特征,亚太地区患病人群占总患病人群的一半以上,我国的发病率也一直居高不下。
此外,老年、男性、应用化疗/放疗等抗肿瘤治疗史、有接触有机溶剂等环境毒素接触史、吸烟以及一些先天性/遗传学疾病如范可尼贫血等是导致 MDS 发病的危险因素。
MDS 的发病机制是什么?
MDS 的发病机制十分复杂,免疫攻击、环境暴露、衰老、放疗和化疗等因素导致微环境变化、免疫失调、成骨细胞功能障碍、体细胞基因突变(表观遗传调控基因及剪接体基因突变)、表观遗传学改变(启动子甲基化)、联合单倍体功能不足等,进而会导致祖细胞凋亡增加、分化缺陷出现克隆性扩增,导致 MDS 启动细胞向 AML 转化。
因此,MDS 的发病与细胞遗传学、免疫系统及骨髓造血微环境等多种因素相关,是一个多步骤的过程,仅一个等位基因的缺失/失活很少会导致肿瘤的发生或恶性克隆的增殖。
2020 NCCN 指南中也提示,MDS 的发病是由 ICUS、IDUS、CHIP、CCUS 逐渐演变到 MDS 的过程,体细胞突变、克隆性染色体核型异常、骨髓造血衰竭、全血细胞减少等也呈渐进发展。
MDS 如何诊断分型?
2016 年,世界卫生组织(WHO)根据血液学特征及骨髓形态特征将 MDS 分为 MDS 伴单系病态造血(MDS-SLD)、MDS 伴环形铁粒幼细胞(MDS-RS)、MDS 伴多系血细胞发育异常(MDS-MLD)、MDS-EB1、MDS-EB2、分类不明确的 MDS(MDS-U)、5q 综合征(5q-syndrome)、儿童难治性红细胞减少症及 MDS-EBT 等类型。
其中 MDS-EB1、MDS-EB2、MDS-EBT 的区别在于外周血幼稚细胞比例分别为 2%-4%,5%-19%,5%-19%;骨髓幼稚细胞比例分别为 5%-9%,10%-19%,20%-29%。
2017 维也纳关于 MDS 诊断的最低标准指出,满足 2 条必要条件、1 条确定标准及 2 条辅助标准即可诊断 MDS。
其中 SF3B1 突变 MDS 还有单独的诊断标准,包括血细胞减少、体细胞 SF3B1 突变、骨髓原始细胞<5%、外周血原始细胞<1%、排除能够按照 WHO 诊断标准分型的 MDS、正常核型或发育异常但不包括 5q/ inv(3)/3q26 的、可合并其他体细胞突变但不能存在 RUNX1/EZH2 突变。

2017 维也纳最低标准
实际上,MDS 的诊断在一定程度上仍然是排除性诊断,需要排除维生素 B12 和叶酸缺乏,接受细胞毒性药物、细胞因子治疗或接触有血液毒性的化学制品或生物制剂等,慢性病性贫血(感染、非感染性炎症或肿瘤)、慢性肝病、HIV 感染,自身免疫性血细胞减少、甲状腺功能减退或其他甲状腺疾病,重金属中毒、过度饮酒,以及一些其他可累及造血干细胞的疾病如再生障碍性贫血、原发性骨髓纤维化、大颗粒淋巴细胞白血病、阵发性睡眠性血红蛋白尿、急性白血病及其他先天性或遗传学血液病。
哪些 MDS 预后好?哪些预后差?
目前,MDS 的预后评分采用了 2012 修订版国际预后评分系统(IPSS-R)。在 IPSS 评分系统中将 MDS 按照骨髓原始细胞数、染色体核型、血细胞减少种系分为 5 种预后分层。
IPSS 评分系统

其中血细胞减少定义为血红蛋白<10、中性粒细胞<1800、血小板<100000,只有 0-1 系血细胞减少评分为 0 分,2-3 系血细胞减少评分为 0.5 分。
在染色体核型的判断中,提示好的预后是指正常染色体核型、仅有-Y、del(5q)、del(20q);预后中等的指+8、single misc 或是双染色体异常;预后较差指≥3 个染色体核型异常,或者是 7 号染色体异常。
根据评分可分为低危、中危 1、中危 2 和高危四组,不同危险分层的中位生存期与至疾病进展时长有所不同。
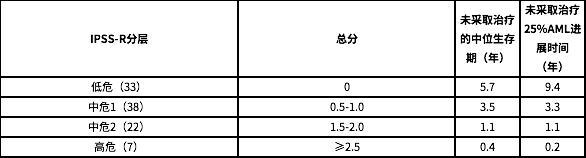
IPSS-R 评分系统
而在 IPSS-R 中,则增加了对细胞减少程度、年龄、LDH、血清铁蛋白、β2 微球蛋白、纤维化和 PS 等的度量。
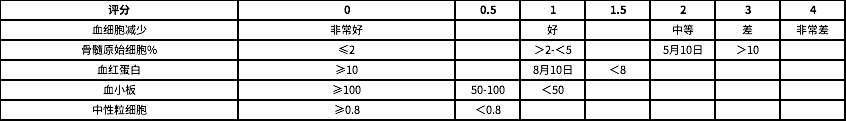
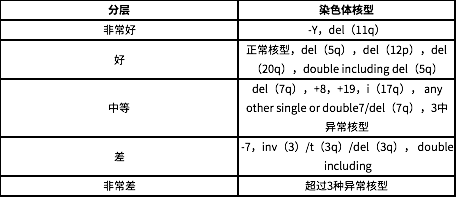
根据 IPSS-R 评分系统,MDS 的预后风险分为非常低(≤1.5 分)、低(1.5-3 分)、中等(3-4.5 分)、高(4.5-6 分)、极高(>6 分),预后评分与患者的中位生存期及向 AML 转化的风险有关。
另外,2020 NCCN 指南还指出了 30 种与预后相关的基因,包括 TET2、DNMT3A、ASXL1、EZH2、SF3B1、SRSF2、U2AF1、ZRSR2、RUNX1、TP53、STAG2、NRAS、CBL、NF1 等,这些基因对治疗反应、药物选择和预后情况都有影响。
其中,SF3B1 属于预后较好的基因,TET2、STAG2、CBL 属于预后中等的基因,DNMT3A、ASXL1、EZH2、SRSF2、U2AF1、ZRSR2、RUNX1、TP53、BCOR 属于预后不良的基因。MDS 患者可能携带某一个基因突变,也可能携带多个基因突变,携带的基因突变越多,预后生存情况越差。
总的来说,MDS 的预后除了跟疾病本身的分型、实验室指标、分子生物学特点有关外,还与其他脏器的合并疾病、患者自身状态等因素有关。
MDS 应该怎么治疗?
对于不同危险程度的 MDS 患者来说,治疗目标也有所不同。国际工作组(IWG)建议,低危 MDS 的治疗以摆脱输血依赖、提高生活质量为目标,治疗以支持治疗、免疫调节剂、免疫抑制剂、生长因子、TPO-RA 为主;高危 MDS 治疗以延缓疾病进展、延长生存为目标,治疗以传统的支持治疗和化疗、去甲基化治疗以及异基因造血干细胞移植为主。
对于 IPSS 评分<1、IPSS-R 评分<3.5 分的较低危患者,无症状仅每 1-3 个月监测血象即可,有症状的患者根据血细胞减少情况进行相应的支持治疗。目前美国食品药品监督管理局(FDA)已经批准了 EPO、GCSF、阿扎胞苷、地西他滨、来那度胺、地拉罗司等药物用于低危 MDS 的治疗。
对于高危 MDS 来说,年龄>65 岁的患者或年龄<65 岁但无合适供者的患者可以选择对症支持治疗或阿扎胞苷治疗;年龄<65 岁且有合适供者的患者,应进行异基因造血干细胞移植治疗。因为目前来说,HSCT 是较高危 MDS 能够根治疾病的唯一办法。
一项研究显示,对于高危患者,异基因造血干细胞移植 20 个月的生存率为 39%,而阿扎胞苷仅为 7%;另外一项国内研究也显示,骨髓移植的总生存率超过 50%,而去甲基化治疗和化疗生存率非常低。对于去甲基化治疗失败的高危 MDS 患者,骨髓移植治疗的生存率仍然接近 50%。
国际专家共识小组建议:对于低危、自身条件差的患者可以不选择移植治疗,但自身条件允许的情况下,如果没有特别高危的因素,可以观察或支持治疗;如果有高危因素或支持治疗失败应当选择异基因造血干细胞移植。对于高危患者,自身条件差和无合适供者的患者可以不选择移植治疗,其他患者均应当选择异基因造血干细胞移植治疗。
另外美国血液学会年会(ASH)上一项研究报告指出,去甲基化药物虽然毒性较低,但是并不能治愈 MDS,只能延长 9 个月左右的生存期,如果有合适供者,还是应该选择异基因造血干细胞移植达到彻底治愈 MDS 的目的。
总的来说,MDS 是一组异质性疾病,需要进行分层化治疗和个体化治疗,对于低危患者主要以对症支持治疗为主,尽可能减低细胞毒药物的使用;对于高危患者应尽早评估移植的可行性,尽可能提高疗效和生存。
作者简介

李智慧医生,高博医学(血液病)北京研究中心,北京博仁医院血液二科(移植技术)三病区,副主任医师。
首都医科大学医学博士;中国医药生物技术协会医药生物技术临床应用专业委员会委员;中国抗癌协会血液肿瘤专业委员会委员。
在 BoneMarrow Transplan,Leukemia & lymphoma,Journal of Pediatric Hematology/Oncology 等杂志发表数篇 SCI 文章;数次在欧洲骨髓移植年会 EBMT,欧洲血液年会 EHA,亚太骨髓移植年会 APBMT,美国血液年会 ASH 等国际血液学大会上发及壁报交流。
在造血干细胞移植 ( HSCT) 治疗白血病、MDS、淋巴瘤、再生障碍性贫血、噬血细胞综合征等疾病及移植合并症的防治方面具有丰富的经验。
*声明:本内容仅代表文章来源方观点,不代表本站立场。本内容仅供医学药学专业人士阅读,不构成实际治疗建议。
关于高博

高博医疗集团专注于打造「医产研」一体化的医疗服务和科技创新平台,深耕血液病、肿瘤等专科领域。其业务范围覆盖医院诊疗服务、临床特殊检验、医学影像、生物制药、基因技术、医疗信息化等领域,建立 1 个医院连锁,以及包括临床检验中心、影像中心、大数据中心、生物治疗研发中心 4 个中心的战略布局,构建完整的医疗生态系统。 集团目前完成北上广三家血液病研究中心,五家医院的布局。共拥有病床 800 张,造血干细胞移植仓 88 间。
- 高博医学(血液病)北京研究中心·北京博仁医院
主要开展独具技术特色的血液病、儿科及综合住院诊治服务,并设有为社区服务的门诊及急诊。医院使用面积 14000 平米,开放病床 170 张。住院病房以血液病、儿科及综合病房为主,设有百级手术室及抢救病房。血液科专家团队具有丰富的临床与实验室经验,包括有 30 多年血液病诊治...
- 高博医学(血液病)广东研究中心·南方春富(儿童)血液病研究院
由李春富教授领衔主持,秉承「生命高于一切」的办院理念。是目前中国唯一专注儿童血液病研究和诊疗的机构,与美国著名医疗集团梅奥诊所 (Mayo clinic) 战略合作,集医疗、教学和科研于一体的医疗机构,其主要任务为利用完善的诊断体系,最先进的化学和生物医疗技术诊治血液病和免...
- 高博医学(血液病)上海研究中心
中心包含两家实体医院,上海闸新医院,以及上海力泉医院。总建筑面积 18000 平,开设床位 356 张,洁净造血干细胞移植层流病房 32 间,配备进口核磁共振和 CT。设立医学检验科、血库、医学影像科、药剂科、康复科等。除常规的临床检验项目外,还能够开展细胞形态学、流式细胞学...
- 上海阿特蒙医院
医院由高博医疗集团、银山资本与德国阿特蒙医疗集团合作成立,是上海自贸区的首家外资综合医院,也是服务业扩大开放的试点工程。医院总规划建筑面积约 60000 平方米,一期开放床位 200 张,二期建成后总床位数约达 500 张。上海阿特蒙医院自规划创办以来便综合考虑自身优势与中...
- 高博医学诊断中心
中心集医疗、教学、科研为一体的整合诊断平台,在北京、上海、广东均设立参考实验室,建立在集团五家具有肿瘤和血液肿瘤专科特色的医院基础之上,依托强大的临床资源,利用临床与检验相结合的模式优势,更加全面深入的理解疾病的诊断,治疗与预后,能够迅速发现临床在诊疗过程...





