隐形杀手——胃肠间质瘤 (GIST) 探秘
在我们日常工作中时常发现的胃、小肠等部位的间质瘤 (有图有真相)。
胃间质瘤
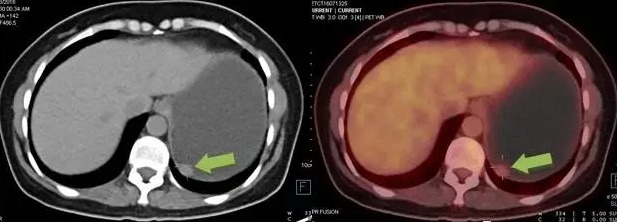
胃间质瘤案例 1:
胃体壁见直径约 1.3 cm 软组织结节向腔内隆起,PETCT 可见 FDG 轻度摄取,行胃镜下摘除术,病理证实为胃间质瘤(低危度)。
小肠间质瘤
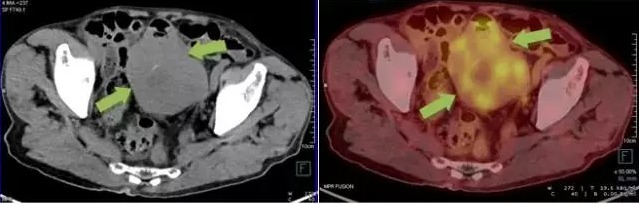
小肠间质瘤案例 1:
因腹痛 CT 发现腹盆腔占位,病灶内可见液化区及钙化灶,FDG 摄取增高。诊为小肠间质瘤。术后病理为:小肠恶性间质瘤。
胃肠间质瘤是一种严重威胁人类健康的疾病,虽有越来越多的患者受到胃肠间质瘤的威胁,但遗憾的是,大众对此疾病仍知之甚少,加上胃肠间质瘤早期具有隐蔽性,症状轻微,未能引起人们的足够重视。其实胃肠间质瘤是我国较为常见的恶性肿瘤之一,是最常见的腹部间叶性软组织恶性肿瘤。
胃肠间质瘤是不是癌症?它有哪些症状?怎样才能早发现早治疗?如何预防?……让我们带着问题去详细了解这个善于潜伏又严重威胁我们健康的敌人吧!
Question:胃肠间质瘤的前世今生和寄居部位?
胃肠间质瘤可位于胃肠壁的粘膜下、肌壁间、胃腔外或腔内外兼而有之,大部分病变即使胃镜检查亦无法发现或明确诊断。其早年长期被误认为是平滑肌瘤或神经源性肿瘤而延误诊断。研究发现,胃肠间质瘤有别于胃癌或肠癌,其来源于胃肠道卡哈尔间质细胞 (Cajalcel1),为胃肠道间叶组织来源的肿瘤 [1],它可发生在消化道的任何部位,其中以胃部原发多见,占 50%-70%;其次是小肠,占 20%-30%;结直肠占 10%-20%;食道占 6% 左右。50 岁-70 岁是该病的高发期。
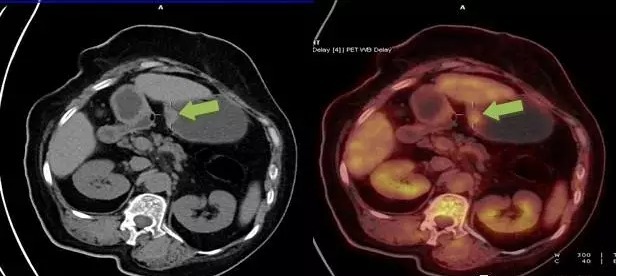
胃间质瘤案例 2:
胃窦壁见直径约 1.8 cm 软组织结节呈宽基底向腔内隆起,PETCT 可见结节 FDG 摄取升高,行胃镜下摘除术后病理为胃间质瘤(中危度)。
Question: 胃肠间质瘤是不是癌症,如何确诊胃肠间质瘤?
临床上,胃肠间质瘤是一种具有潜在恶性倾向的侵袭性肿瘤,组织病理学诊断仍是金标准,其恶性程度取决于肿瘤大小及有丝分裂指数来评估。2001 年美国国立卫生研究院 (NIH) 制定了基于肿瘤大小和核分裂象的间质瘤生物学行为的诊断标准 [1]:
1. 直径<2 cm,<5 个/50 HPF 提示危险程度很低;
2. 直径 2 cm-5 cm,<5 个/50 HPF 提示低危;
3. 直径<5 cm、6 10 个/50 HPF,或直径>5 cm-10 cm、<5 个/50 HPF 则为中危;
4. 直径>5 cm、>5 个/50 HPF,或只要直径>10 cm 或>10 个/50 HPF 即视为高危。
超声内镜 EUS 引导下活检行病理、免疫组化检查并检测其 C-kit 基因突变情况,如将它们联合起来可使间质瘤诊断准确性高达 90% 以上。
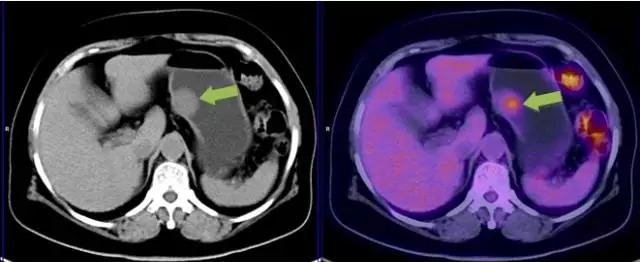
胃间质瘤案例 3:
胃体小弯侧壁见直径约 2.4 cm 软组织结节向腔内隆起,PETCT 可见结节有 FDG 较明显摄取增高,行胃镜下摘除术病理证实为胃间质瘤(高危度)。
Question: 患胃肠间质瘤可有何临床症状?
据文献回顾性研究统计,胃肠间质瘤在早期较小时基本无症状,即使随着瘤体的增大,亦无特异性症状,患者可表现出一些消化道常见症状,如恶心、呕吐、腹痛、黑便和贫血等,部分患者可能出现肠梗阻症状,因此极容易被忽视和漏诊。很多患者都是在肿瘤筛查、体检或其他手术时无意中发现罹患此病。据目前文献报道在首次就诊的胃肠间质瘤患者中,有 20%-30% 的患者已发展成为晚期;有 11-47% 的患者已发生肝转移和腹腔转移,错过了最佳治疗时机。故体检筛查此病的必要性是显尔易见的。
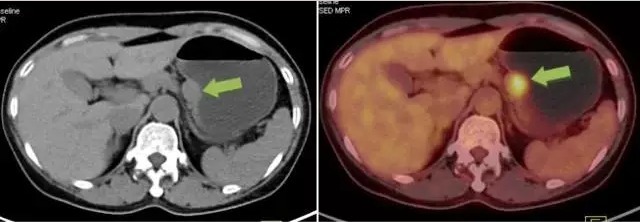
胃间质瘤案例 4:
胃镜仅粘膜下隆起,超声胃镜可见胃体小弯侧壁肌层及下层软组织结节,直径约 1.8 cm, PETCT 可见结节有明显 FDG 摄取增高,手术病理证实为胃间质瘤(高危度)。
Question:我们应该如何筛查此类肿瘤?
胃肠间质瘤的影像学检查
由于症状缺乏特异性,胃肠间质瘤往往难以早期发现,尤其是直径小于两厘米的肿瘤可能没有任何症状,过半的间质瘤检出是因为偶然发现。故检测间质瘤,以下影像学检查方法成为当仁不让的选择:
(1)超声内镜:
超声内镜(Endoscopic Uhrasonography.EUS)是目前诊断黏膜下肿瘤最为准确的方法,亦是用于诊断和术前评价间质瘤的一个最有价值的手段。EUS 显示不规则的边缘、内部回声不均和液性暗区是恶性间质瘤的表现,具备其中两项,即可判断为恶性间质瘤,其敏感性可达 80%~90%。
(2)PET/CT 全身扫描:
PET/CT 已广泛应用于临床诊断多年,PET/CT 在为我们提供病灶解剖学信息的同时,还能够提供功能代谢的信息,具有非常重要的临床价值,越来越多地被应用于对胃肠间质瘤原发肿瘤、肿瘤复发及靶向药物治疗反应的早期评估等方面 [2],目前的大多数研究集中于病变 FDG 摄取量化值与其恶性程度关系方面以及转移病灶诊断诊断可靠性方面的研究 [3],大多数研究认为 PET/CT 可作为对 GIST 患者治疗疗效评估的金标准,国外研究发现:PET/CT 18F-FDG 摄取程度的改变可以反映肿瘤细胞的代谢水平,其发生改变要先于肿瘤体积大小的改变,具有非常好的早期预测疗效的价值 [4 5 6 7]。PET/CT 不仅可以显示大多数胃肠道间质瘤代谢活性的增高,同时还可以显示治疗开始后的早期相关功能改变情况,并且治疗后 18F-FDG 摄取减低与治疗有效或永久性的 PFS(progression—free survival,PFS) 有关,因此广泛应用于靶向药物疗效的监测 [8]。
(3)腹部 CT 扫描:
使用静脉和口服造影剂进行腹部 CT 扫描是评价间质瘤的一个重要方法,它能够发现起源于胃壁的肿瘤,以及是否侵及邻近器官、有无腹腔内或淋巴结转移。其 CT 主要表现为:
1. 提示恶性间质瘤的 CT 表现有:直径>10 cm;有出血、坏死、扩散;以外向性生长为主,形状欠规则,呈分叶状;腔面侧溃疡大而深并形成气液平,并向周围组织浸润以致与周围组织分界不清;瘤体旁细小血管。
2. 提示良性间质瘤则有:形状规则,直径<5 cm,腔内生长或混合生长,肿瘤组织钙化,结构均一。
3. 提示交界性则有:肿瘤直径:6~10 cm。
(4)胃镜:
作为有上消化道症状病人的首要检查,是发现可疑间质瘤最常用的检查方法。但因其无法透壁观察病变性质且间质瘤多位于肌层而无法获取病理学证据,需要进一步依靠超声内镜。
(5)X 线钡餐、B 超检查:
钡餐可有助于发现病灶及有无溃疡,但诊断效果较差。B 超:受检查原理限制仅能检出较大实性占位,较少用于对此病的诊断。
(6)MRI:
MRI 组织对比度好,多方位成像和化学位移正、反相位成像有助于判断肿瘤原发灶与邻近器官、大血管的关系。尤其对直肠间质瘤的诊断 MRI 优于 CT,MRI 通过三维成像,直观反映病变与周围脏器的关系,对病灶定位和范围及囊性部分的诊断均优于 CT。
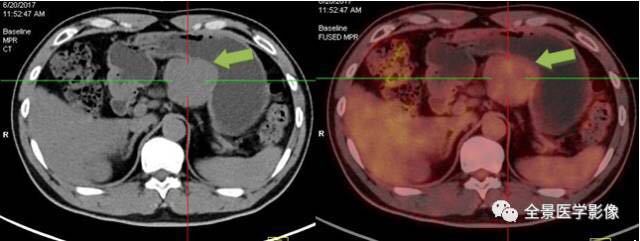
胃间质瘤案例 5:
体检发现胃体小弯侧腔外生长直径 5.6 cm 软组织肿块,PET/CT 扫描见肿瘤 FDG 轻度摄取增高,手术切除病理为:间质瘤(混合细胞型,8/50 HPF 高危度)。
Question :PET/CT 在胃肠间质瘤应用中的价值?(重要的问题强调一次)
1. 检出病灶,一次检查可发现消化道全程的潜在间质瘤可能。
2. 术前无创评估肿瘤良恶性可能,准确提出肿瘤的分期,利于治疗方案的选择和准备。
3. 术后病人的全身评估,对于疑似转移病灶的定性极为准确。
4. 靶向药物治疗后疗效精确评估。较传统的影像学检查发现认为的体积评估更有效和准确,PET/CT 可根据肿瘤 SUV 值的改变更准确的评估肿瘤活性,并预判远期疗效,研究发现:PET 显示治疗有效者 1 年生存率达到 92%,而 PET 显示无效者 1 年生存率仅 12%[9]。
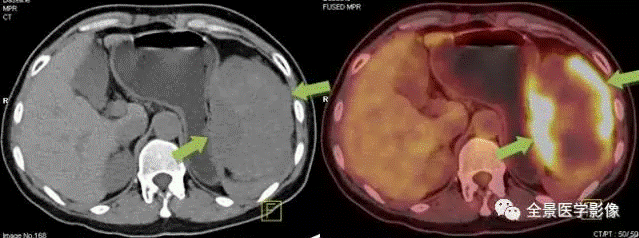
胃间质瘤案例 6:
因腹腔占位来诊,PETCT 扫描见肿瘤位于胃体旁,部分层面与胃体分界不清。术后病理:间质瘤(高危度)。
Question:日常生活中,我们应该如何预防胃肠间质瘤?
胃肠间质瘤是一种严重威胁人民身体健康的疾病,因此预防胃肠间质瘤的发生对每个人来说都是至关重要的。那该从哪些方面预防胃肠间质瘤?
(1) 不吃霉变的食物
霉变是由污染霉菌所引起,霉菌中有些是产毒真菌,是很强的致癌物质,同时某些食物在产毒真菌作用下产生大量的亚硝酸盐和二级胺,进入机体后在一定条件下,胃又可合成亚硝胺类化合物而致癌。
(2) 不吸烟、少饮酒
吸烟与胃肠间质瘤也有一定的关系,烟雾中含有苯并芘、多环芳香烃、二苯并卡唑等多种致癌或促癌物质,是食管癌和胃肠间质瘤的病因之一。酒精本身虽不是致癌物质,但烈性酒会刺激胃粘膜,损伤粘膜组织,促进致癌物质的吸收,如果饮酒同时吸烟,其危害性更大。因为酒精可增强细胞膜的通透性,从而加强对烟雾中致癌物质的吸收。
(3) 要养成良好的饮食习惯
若饮食不定时定量、暴饮暴食、进食过快过烫,对胃是一个损伤性的刺激,与胃肠间质瘤的发生有一定的关系。同时,食盐摄入量大,进餐时好生闷气与胃肠间质瘤也有关系。
(4) 多吃新鲜蔬菜和水果
多吃含维生素 A、B、E 的食物,适当加强蛋白质摄入,以利保护胃粘膜。
(5) 积极治疗癌前病变
患萎缩性胃炎、胃溃疡、胃多发性腺瘤性息肉、恶性贫血的人,必须经常到医院检查治疗,消除癌前病变,预防胃肠间质瘤的发生。
参考文献:
[1]:Fletcher CD,Berman JJ,Corless C,eta1.Diagnosis of gastrointestinal stromal tumors:A consensus approach[J].Hum Pathol,2002,33(5):459—465.
[2]: 袁磊磊梁英魁 杨吉刚 18F—FDG PET 显像在胃肠道间质瘤患者疗效评估中的应用 Journalof Clinical and Experimental Medicine Vo1.13.No.20 Oct.2014
[3]:Otomi Y,OtsukaH,Morita N,et a1.Relationship between FDG uptake and the pathological risk categoryin gastrointestinal stromal tumors[J].J Med Invest,2010,57(3—4):270—274.
[4]:Lassau N,Chami L,Koscielny S,et a1.Quantitativefunctional imagingby dynamic contrast enhanced ultrasonography(DCE—US)in GISTpatients treated with masatinib[J].Invest New Drugs,2012,30(2):765—771.
[5]: Demetri GD,Heinrich MC,Fletcher JA,et a1.Moleculartarget modulation,imaging,andclinical evaluation of gastrointestinal stromal tumor patients treated withsunitinib malate after imatinib failure[J].Clin CancerRes,2009,15(18):5902—5909.
[6] :Maurel J,Martins AS,Poveda A,et a1.Imatinibplus low—dose doxo.
ruhicin in patients with advanced gastrointestinalstromal tumors refract-toryto high—doseimatinib:a phaseI-II study by the Span ish Groupfor Research on Sarcomas[J].Cancer,2010,116(15):3692—3701.
[7]:Benjamin RS,Sehofski P,Hartmann JT,et a1.Eficacyand safety of motesan ib,an oral inhibitor of VEGF,PDGF,and Kit receptors,inpatients with imatinib—resistantgastrointestinal stromal tumors[J].Cancer Chemother Pharmaeol,2011,68(1):69—77.
[8]: Menu Y. Evaluation of tumour response totreatment with targeted therapies:standard ortargeted criteria? Bull Cancer,2007,94:231~239.
[9]: Trent JC,Ramdas L,Dupart J,et a1.Early effects of imatinib mesylateon the expression of insulin-like growth factor binding protein-3 and positronemission tomography in patients with gastrointestinal stromal tumor.Cancer,2006,107:1898-1908.
声明:文中所有案例及影像图片版权均为全景所有,盗用必究
